Kohlenstoff
Kohlenstoff ist ein chemisches Element mit physikalischen Eigenschaften sowie biologischer Funktion und daher mitverantwortlich für die Existenz sämtlicher Geisteswissenschaften. Es ist das zweitwichtigste Element auf der Erde und auf Beetlejuice und das drölftwichtigste im Universum. Im Perry-Rhodan-System der Elemente steht es an sechster Stelle, eingezwängt zwischen Bor und Stickstoff. Gegen Tieferrutschen ist der Kohlenstoff, wie manch anderes auch, durch ein Silikonpolster geschützt.
|
| |
| Symbol | C |
| Ordnungszahl | 6 |
| Serie | Garnichtmetalle (noch nichtmal halb) |
| Elektronenkonfiguration | 1s22s22p2 (wie Magnesium, nur anders) |
| Atommasse | schwankend |
| Modifikationen | 3: Graphit (G), Diamant (D) und Brikett (B) |
| Aggregatzustand | fest (G, B) bis saufest (D) |
| Kristallstruktur | G: verhext diagonal D: komisch egozentriert |
| Aussehen | G: hellschwarz D: farblos B: dunkelschwarz |
| Geschmack | Schon mal ’ne Pizza im Ofen vergessen? |
| Dichte | G: 2,26 g/cm3 D: 3,51 g/cm3 B: undicht |
| Sublimationspunkt | 3915 v. Chr. |
| Heizwert | G, D: 9,1 kWh/kg B: ca. 25 MJ/kg |
| Magnetismus | diarrhoemagnetisch |
Schon die Römer kannten den Kohlenstoff gut; sie drangen bereits früh in das größte Kohlenstofffeld der Welt vor und gründeten dort einige bekannte Kolonien. Was sie nicht wussten ist, wie man ein ordentliches „K“ schreibt; deshalb verpassten sie dem Stoff, aus dem die Kohle ist, die Bezeichnung carbo. Daraus – und nicht, wie von unseriösen Quellen immer wieder behauptet, aus einem bedauerlichen Tippfehler – entstand das Elementsymbol C.
Atomarer Aufbau
Den Kern des Kohlenstoffs teilen sich sechs HIV-positive Protonen mit ebenso vielen Neutronen, denen ihre Mitbewohner ziemlich egal sind. Von Zeit zu Zeit mogeln sich noch ein oder zwei weitere neutrale Teilchen in die Gemeinschaft, ohne dass es zu größeren Konflikten kommt. Weitere Gäste werden jedoch, wenn überhaupt, nur für wenige Sekunden geduldet.
Umschwirrt wird der Atomkern von sechs Elektronen: Vier davon sind echte Draufgängertypen, die alle Orbitale in Bewegung setzen, um einen paarungswilligen Partner zu finden. Die anderen beiden sind dazu viel zu schüchtern, sie bleiben lieber in der Nähe des schützenden Kerns, lassen sich durch nichts aus der Bahn bringen und tragen so signifikant zur Verbesserung des allgemeinen Atomklimas bei.
Vorkommen
Kohlenstoff ist ein essentielles Element, ohne das es kein lebendes Gewebe und keine Bleistifte gäbe. Trotzdem ist Kohlenstoff relativ rar, sein Anteil an der Erdhülle ist geringer als 0,09 % – sehr erstaunlich, wenn man bedenkt, dass hier die organisch-idiotische Masse vollständig eingerechnet ist.
Kohlenstoff in elementarer Form findet sich in Form von Diamanten oder Graphit. Die größten Diamantenvorkommen liegen passenderweise dort, wo es relativ unproblematisch ist, Menschen unter lebensgefährlichen Bedingungen in einsturzgefährdeten Minen arbeiten zu lassen (Afrika, Russland). Auch Graphit wird teilweise unter Tage abgebaut; die bekanntesten Bleistiftminen befinden sich in China, Indien und in der Steiermark.
Sehr viel häufiger als elementarer Kohlenstoff ist essentieller Kohlenstoff. Das weltweit beeindruckendste Kohlenstofffeld befindet sich direkt unterhalb des fünftgrößten Ballungsraums Europas nördlich des Flusses, nach dem die gleichnamige Krankheit benannt wurde. Nennenswerte Vorkommen finden sich auch in den Auspuffrohren von Dieselfahrzeugen. Die industrielle Gewinnung dieser Bestände mittels Feinstaubfiltern hat sich jedoch als nicht wirtschaftlich erweisen.
Erscheinungsformen
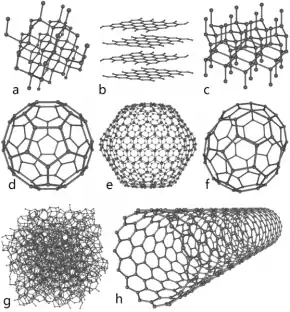
g) Abstrakter Kohlenstoff, h) Rollgraphen
Verbinden sich Kohlenstoffel nur mit anderen Kohlenstoffeln, spricht man von elementarem Kohlenstoff. Je nachdem, in welchen Orbitalen sich die Draufgängerelektronen paaren, also welche Stellungen sie bevorzugen, entstehen dabei unterschiedliche Modifikationen:
Graphit
Im Graphit formen die sp2-kovalent verhext diagonal gebundenen Kohlenstoff-Atome hochfeste Ebenen, die untereinander nur locker über Wanderwal-Kräfte gebunden sind. Graphit entwickelt undurchsichtige, hellschwarze Kristalle, die auf rauen Unterlagen graue Striche hinterlassen. Das wussten offenbar schon die alten Griechen, denn sie gaben dem Graphit (von γραφειν = „schreiben“) seinen Namen. Wie üblich ignorierten die Engländer im 16. Jahrhundert das antike Wissen und behaupteten hartnäckig, es handle sich um Bleiglanz. Die Tatsache, dass die Deutschen diesen Fehler unreflektiert übernahmen und ihre Graphitstifte Bleistifte tauften, zeugt von ähnlich großer Ignoranz.
Anfang des 19. Jahrhunderts bewirkte Napoleon beim Versuch, seinen Minderwertigkeitskomplex zu kompensieren, ein Exportverbot für Bleistifte. Kein einziger Graphitschreiber durfte mehr von Großbritannien nach Frankreich ausgeführt werden, denn auch diese Minen erwiesen sich als perfektes Kriegsmaterial – für Gussformen von Kanonenkugeln.
Diamant
Im Diamanten bilden die sp3-kovalent tetrapakal gebundenen Kohlenstoff-Atome ein komisch egozentriertes Kristallgitter. Für gewöhnlich sind Diamanten farblos, weshalb es ausgesprochen schwierig ist, sie überhaupt zu finden. Mittlerweile gibt es diese Form des Kohlenstoffs im gut sortierten Einzelhandel aber in allen Farben, sogar in braun. Auch braune Diamanten finden ihre Liebhaber, solange klangvolle Farbbezeichnungen wie „champagner“ oder „cognac“ geschickt von der wahren Scheißfarbe ablenken. Die farblosen Exemplare erfreuen sich größter Beliebtheit bei Frauen, Gangsta-Rappern und Elstern.
Der Diamant besitzt die höchste Härte aller bekannten Materialien, auch wenn sich im allgemeinen Sprachgebrauch der Kruppstahl-Komparativ durchgesetzt hat. Diamanten sind so hart, dass man mit ihnen sogar Diamanten schleifen kann. Auch zur energetischen Verwertung sind Diamanten aufgrund ihres hohen Heizwertes gut geeignet. Die CO2-Bilanz fällt jedoch eher ungünstig aus, bei der Verbrennung entstehen pro Karat immerhin 733 mg CO2. Umgerechnet bedeutet dies, dass ein 50.000-Karat-Diamanten-Lagerfeuer die gleiche Menge CO2 emittiert wie ein Porsche Cayenne Turbo S im Drittelmix auf 100 km.
Brikett

Brikett ist eine besondere Modifikation des essentiellen Kohlenstoffs, die unter hohem Druck entsteht. Vorkommen gibt es auf der ganzen Welt außer im zeitnahen Osten. Die förderfähigen Reserven schrumpfen jedoch zusehends; bereits heute gelten die meisten Kohlenkeller als überfischt. Neueren Erkenntnissen der Kohleforschung zufolge kann sich Brikett auch bei der Verbrennung von Dieselkraftstoffen bilden. Voraussetzung hierfür sind a) ein Kraftstoffgemisch mit hohem Schwerölanteil, b) eine unvollständige Verbrennung durch möglichst verhunzte Einspritzdüsen und c) ein geeignetes Kraftfahrzeug, dessen Motor für längeren Betrieb im Grenzbereich ausgelegt ist (vorzugsweise Baujahr 1989 oder früher).[1]
Fußballimitate
Unter speziellen Bedingungen lassen sich aus Graphit Fußballimitate (s. Abb. oben) herstellen. Diese wurden von der FIFA jedoch bisher nicht als offizielle Spielgeräte zugelassen, da sie – bis auf eine einzige Ausnahme, das sogenannte Fi-Fa-Fulleren (in obiger Abb. unschwer als Form d) zu identifizieren) – in ihrer Form noch nicht ausgereift sind. Zudem sind selbst Kinder und Zwergenwüchsige hoffnungslos überfordert, wenn es ums Dribbeln und Toreschießen geht.
Aktivkohle
Aktivkohle ist eine besonders poröse Form des essentiellen Kohlenstoffs, die sich aus pflanzlichen, tierischen, mineralischen oder petrochemischen Stoffen gewinnen lässt. Das bekannteste Verfahren ist die Gasaktivierung, bei der bereits verkohltes Material in einem oxidierenden Gasstrom behandelt wird, gemeinhin bekannt unter der Trivialbezeichnung Grillen.
Wegen ihrer ausgeprägt diarrhoemagnetischen Eigenschaften wird Aktivkohle in der Medizin häufig bei Durchfallerkrankungen eingesetzt.
Verbindungen
Der Kohlenstoff ist ständig bestrebt, sich mit elektropositiveren, elektronegativeren oder subversiven Elementen zu verbinden und auf diese Weise allerlei gewöhnliche und merkwürdige Substanzen zu bilden.
Die Harten
Sind die äußeren Elektronen des Kohlenstoffs schlecht gelaunt, gehen sie unter der Erde oder unter den Metallern auf Brautschau. Mit ihrer ausgeprägt elektro-negativen Einstellung ist die Chance groß, hier den passenden Verbindungspartner aufzugabeln. Im Gegensatz zu anderen paarungswilligen Elementen interessiert sich der Kohlenstoff hier nicht für One-Night-Stands und flüchtige Bekanntschaften, sondern legt es sofort auf feste Bindungen an. Aus erfolgreichen Annäherungsversuchen gehen nach weniger als neun Monaten Carbide hervor; hat der Papa einen doofen Vornamen, entsteht z. B. Wolframcarbid. Carbide gehören zu den ganz Harten; sie haben später gute Berufschancen als Schneidwerkzeuge.
Kohlenstoffsauereien

Bei positiver Grundstimmung seiner äußeren Elektronen veranstaltet der Kohlenstoff gerne Sauereien und bindet sich dazu mit Sauerstoff (klar!).
Kohlenstoffmonoxid
Kohlenstoffmonoxid ist besser bekannt als Kohlenmonoxid, gasförmig und fies: Du siehst es nicht, riechst es nicht, schmeckst es nicht, spürst es nicht und plötzlich siehst, riechst, schmeckst und spürst du gar nichts mehr, denn du bist tot. Da ist Phosgen doch sympathischer, das stinkt zumindest anständig. Mit seiner Heimlichtuerei schafft es das gemeine CO auf Platz 1 der Weltrangliste der giftigen Substanzen mit endgültiger Wirkung. Laut einer amerikanischen Studie, die zwar amerikanisch, aber trotzdem eine Studie ist, starben zwischen 1979 und 1988 über 56.000 Menschen an einer Kohlenmonoxidvergiftung. Selbst wenn man die 25.000 Idioten abzieht, die sich durch konsequentes Inhalieren von Automobilabgasen Zutritt zu höheren Sphären erhofften, sind das immer noch viele. Umso erstaunlicher ist es, dass hierzulande immer wieder gerne Heizlüfter in geschlossenen Räumen betrieben werden.
Kohlenstoffdioxid
Kohlenstoffdioxid, einfacher Kohlendioxid oder noch einfacher Zeozwei ist eine doppelt so große Sauerei wie Kohlenmonoxid – logisch, denn es enthält schließlich doppelt soviel Sauerstoff. Kohlendioxid wird von den meisten Lebewesen ausgeatmet; trotzdem behaupten Chemiker hartnäckig, es sei geruchlos. Sicher ist, dass Kohlendioxid schuld daran ist, dass Deutschland in ein paar Jahren von Holländern überschwemmt werden wird, weil Holland überschwemmt sein wird.
- Mehr Lesenswertes zum Thema: siehe Hauptartikel CO2
Kohlensäure
Kohlensäure ist die Säure, an der Chemieschüler verzweifeln – nicht nur beim Öffnen der Cola-Flasche, die ihr hinterhältiger Banknachbar zuvor mit porösen Kaubonbons präpariert hat. Kohlensäure entsteht, wenn Kohlendioxid mit Wasser reagiert – tut es aber nicht. Beim Lösen von CO2 in H2O erhält man in erster Linie in H2O gelöstes CO2. Der resultierende Anteil an Kohlensäure ist kleiner als der aktuelle Zinssatz auf dem Tagesgeldkonto. Der Rest ist völlig abgedrehte Chemie beziehungsweise irgendwas zwischen Sprudelwasser und Kesselstein.
- Weniger Lesenswertes zum Thema: siehe Hauptartikel Kohlensäure
Schmuckstücke
Stehen keine oder nicht genügend willige Bindungspartner zu Verfügung, neigt der Kohlenstoff zur Autoerotik und steigt ins Schmuckgewerbe ein: Er paart sich mit sich selbst und bildet Ketten, Ringe oder Würfel für Rollenspiele.
Ketten
Kohlenstoffketten sind allgegenwärtig. Es gibt sie in beliebigen Längen und Ausführungen, mal schlicht und ohne unnötigen Klimbim, mal überladen mit Anhängseln in allen erdenklichen Formen. Schon die Natur hat unzählige Varianten im Angebot, aber dem konsumorientierten Menschen ist das alles nicht genug; er muss noch mehr davon haben – viel mehr.
Die schlichtesten Ketten, die nur aus Kohlenstoff und Wasserstoff bestehen, geben als Zierrat nicht viel her und werden daher meist verheizt. Eine Ausnahme bilden die richtig langen Kohlenwasserstoffketten: Sie werden zu hochwertigen Verpackungen verarbeitet, nach Gebrauch im gelben Sack gesammelt und dann verheizt.
Zu den bekanntesten natürlichen Kohlenstoff-Verkettungen gehören die Kohlenhydrate, vor deren schädlichen Einfluss auf den menschlichen Stoffwechsel Hobby-Ökotrophologen immer wieder warnen. Angeblich dienen sie den kleinen Tierchen, die nachts heimlich die Kleidung enger nähen, als perfekter Nährboden für ungestüme Vermehrung. Laut diverser „Ruckzuck-schlank-ohne-zu-hungern-Artikel“ der in Frisörgeschäften und Wartezimmern erhältlichen Fachliteratur, macht Fett abends weniger fett.
Ringe
Wenn der Kohlenstoff ringelpiezt und der Wasserstoff mit anfassen darf, entstehen ver(b)rückte oder aromatische Kohlenwasserstoffe. Letztere riechen zwar oft gut, wirken aber nicht unbedingt so – zumindest nicht „gut“ im Sinne von „gesundheitsfördernd“. Gesellen sich noch Sauerstoff oder Stickstoff oder beide hinzu, kann das allgemeine Wohlbefinden nachhaltig leiden. Von ausgiebigen Bädern in Nitrobenzol oder Trinitrotoluol ist daher abzuraten.

Polyeder
Viele Kohlenstoffverbindungen haben irrsinnig komplizierte Namen, manche auch ganz gewöhnliche, dafür aber witzige Formen, z. B. die Platonischen Kohlenwasserstoffe. Sie wären prima als universeller Rollenspiel-Würfelsatz geeignet, wenn nicht zwei davon nur theoretischen Charakter hätten und das dritte nicht an seiner zu hohen Ringspannung zerbrechen würde.
Literatur
- [1] G. Rillmaster und B. Rikett: What your diesel truck can do to improve your barbecue in Journal of Applied Nonsense, Issue 123 (1990), S. 664–668


Alles, was der Stupidedia-Chemiefachhandel im Elementesortiment zu bieten hat...
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
